解答题-实验探究题 适中0.65 引用1 组卷60
汽车尾气中含有CO、NO、NO2等多种污染物。
(1)在汽车的排气管上装一个催化转换装置,能使CO和NO反应生成无污染的气体,写出该反应的化学方程式_____
(2)研究表明:增大催化剂(相同质量下比较)比表面积可提高化学反应速率,为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了三组实验,部分实验条件已经填在下面实验设计表中。
请在上表格中填入剩余的实验条件数据,三组实验中的反应速率由快到慢的顺序为______ (填实验编号)
(3)大众"检测门"事件让"尿素可用于汽车尾气脱氮”又科普了一把,其反应原理为:NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O
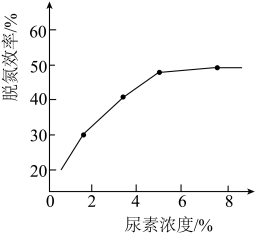
① 图为尿素含量对脱氮效率的影响,一般选择尿素浓度约5%左右,其原因是_______
②当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO):V(NO2)=3:1时,可通入一定量的空气,同温同压下,V(空气):V(NO2)=_____ (空气中氧气的体积含量大约为 20%)
(1)在汽车的排气管上装一个催化转换装置,能使CO和NO反应生成无污染的气体,写出该反应的化学方程式
(2)研究表明:增大催化剂(相同质量下比较)比表面积可提高化学反应速率,为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T/℃ | CO 初始浓度/mol·L-1 | NO 初始浓度/mol·L-1 | 催化剂的比表面积/m²·g-1 |
| Ⅰ | 300 | 4.5×10-3 | 1.5×10-3 | 100 |
| Ⅱ | 4.5×10-3 | 1.5×10-3 | 200 | |
| Ⅲ | 500 | 4.5×10-3 | 200 |
请在上表格中填入剩余的实验条件数据,三组实验中的反应速率由快到慢的顺序为
(3)大众"检测门"事件让"尿素可用于汽车尾气脱氮”又科普了一把,其反应原理为:NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O

① 图为尿素含量对脱氮效率的影响,一般选择尿素浓度约5%左右,其原因是
②当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO):V(NO2)=3:1时,可通入一定量的空气,同温同压下,V(空气):V(NO2)=
19-20高一·江苏苏州·期中
类题推荐
汽车尾气中含有CO、NO等有害气体,某新型催化剂能促使NO、CO发生如下反应2NO+2CO 2CO2+N2,将NO、CO转化为无毒气体。回答下列问题:
2CO2+N2,将NO、CO转化为无毒气体。回答下列问题:
(1)为了测定在该催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
前2min内的平均反应速率v(CO2)=___________ 。0~1min和1~2min时间段内反应速率变化的主要原因是___________ 。
(2)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证不同条件对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表格中。
①实验I、II的目的是___________ ,实验II选择的实验条件是:温度___________ 、c(NO)=___________ 。
②对比实验I、III,改变的条件是___________ 实验III选择的c(CO)=___________ 。
(1)为了测定在该催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/min | 0 | 0.5 | 1 | 1.5 | 2 | 2.5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
前2min内的平均反应速率v(CO2)=
(2)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证不同条件对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表格中。
| 实验编号 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 催化剂的比表面积/m2•g-1 |
| I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| II | 5.80×10-3 | 124 | ||
| III | 350 | 1.20×10-3 | 82 |
①实验I、II的目的是
②对比实验I、III,改变的条件是
汽车尾气中含有CO、NO等有害气体,某新型催化剂能促使NO、CO发生如下反应2NO+2CO 2CO2+N2,将NO、CO转化为无毒气体。回答下列问题:
2CO2+N2,将NO、CO转化为无毒气体。回答下列问题:
(1)为了测定在该催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
前4s内的平均反应速率v(CO2)=____ 。0~1s和1~2s时间段内反应速率变化的主要原因是____ 。
(2)一定温度下,在固定容积的密闭容器中,通入1molCO和1molNO,在催化剂作用下发生反应。下列能作为反应达到平衡状态的依据的是____ (填序号)。
a.单位时间内消耗1molCO,同时生成1molNO
b.单位时间内断裂氮氧键的数目与断裂氮氮键的数目相等
c.NO的浓度与CO浓度相等
d.容器内总压强不再改变
(3)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证不同条件对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表格中。
①实验I、II的目的是____ ,实验II选择的实验条件是温度____ 、c(NO)=____ ,c(NO)=____ 。
②对比实验I、III,得出的结论是____ 。
(1)为了测定在该催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2,.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(2)一定温度下,在固定容积的密闭容器中,通入1molCO和1molNO,在催化剂作用下发生反应。下列能作为反应达到平衡状态的依据的是
a.单位时间内消耗1molCO,同时生成1molNO
b.单位时间内断裂氮氧键的数目与断裂氮氮键的数目相等
c.NO的浓度与CO浓度相等
d.容器内总压强不再改变
(3)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证不同条件对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表格中。
| 实验编号 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 催化剂的比表面积/m2•g-1 |
| I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| II | 124 | |||
| III | 350 | 1.20×10-3 | 5.80×10-3 | 82 |
②对比实验I、III,得出的结论是
天空不是垃圾场,污染气体不能随便排,研究大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g)△H=-a kJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-b kJ·mol-1(b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中放出的热量为_________ kJ(用含有a和b的代数式表示)。
(2)已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1)△H=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mol
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mol
请写出H2燃烧热的热化学方程式______________________________________ 。
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如下图所示:
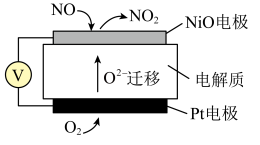
①NiO电极上发生的是_______________ 反应(填“氧化”或“还原”)。
②Pt电极上的电极反应式为_______________ 。
(4)一种新型催化剂能使NO和CO发生反应:2NO+2CO 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
①请把表中数据补充完整:A_______________ ;B_______________ 。
②能验证温度对化学反应速率影响规律的是实验_______________ (填实验序号)。
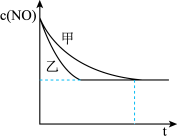
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如下图所示,其中表示实验Ⅱ的是曲线_________ (填“甲”或“乙”)。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g)△H=-a kJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-b kJ·mol-1(b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中放出的热量为
(2)已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1)△H=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mol
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mol
请写出H2燃烧热的热化学方程式
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如下图所示:

①NiO电极上发生的是
②Pt电极上的电极反应式为
(4)一种新型催化剂能使NO和CO发生反应:2NO+2CO
| 实验 编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | B | 124 |
| Ⅲ | 350 | A | 5.80×10-3 | 82 |
②能验证温度对化学反应速率影响规律的是实验
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如下图所示,其中表示实验Ⅱ的是曲线

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


