解答题-原理综合题 适中0.65 引用1 组卷130
汽车尾气排放的CO、NOx等气体是大气污染的主要来源,NOx也是雾天气的主要成因之一。
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无污染的气体,已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH3=+393.5kJ·mol-1
①C(s)的燃烧热ΔH=__ 。
②请写出CO和NO生成无污染气体的热化学方程式为__ 。
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g) 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
①下列说法正确的是__ 。
A.实验2容器内压强比实验1的小
B.在0→10min内实验2的反应速率υ(O2)=0.015mol/(L·min)
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
②不能判断反应已达到化学平衡状态的是__ 。
A.容器内的气体压强不变
B.2v正(NO2)=v逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为P0kPa,在800℃温度下该反应的平衡常数Kp=__ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2mol,平衡将__ (填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)。
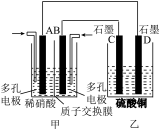
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为__ (填化学式);A电极的电极反应式为__ 。
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无污染的气体,已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH3=+393.5kJ·mol-1
①C(s)的燃烧热ΔH=
②请写出CO和NO生成无污染气体的热化学方程式为
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g)
 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。| 时间(min) 浓度(mol/L) 实验序号/温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| 实验1/800℃ | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
| 实验2/800℃ | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
| 实验3/850℃ | 1.00 | 0.50 | 0.40 | 0.35 | 0.35 | 0.35 |
A.实验2容器内压强比实验1的小
B.在0→10min内实验2的反应速率υ(O2)=0.015mol/(L·min)
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
②不能判断反应已达到化学平衡状态的是
A.容器内的气体压强不变
B.2v正(NO2)=v逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为P0kPa,在800℃温度下该反应的平衡常数Kp=
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为

19-20高三下·重庆·期中
类题推荐
研究发现,氮氧化物和硫氧化物是雾霾的主要成分。回答下列问题:
(1)有下列反应:①N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol-1
②C(s)+O2(g)= CO2(g) ΔH = -393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH = - 221.0 kJ·mol-1
已知某反应的平衡常数K= ,该反应的热化学方程式为
,该反应的热化学方程式为______ 。
(2)往1L恒容密闭容器中充入一定最的NO2,在三种不同条件下发生反应:2NO2(g) 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表所示(不考现NO2生成N2O4的反应)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表所示(不考现NO2生成N2O4的反应)。
①下列说法正确的是____ (填标号)。
A.平衡时,实验2容器内气体压强比实验1的小
B.由实验2和实验3可判断该反应是放热反应
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
E.在0~10 min内,实验2的反应速率 (O2)=0.015 mol·L-1·min-1
(O2)=0.015 mol·L-1·min-1
②不能判断该反应已达到化学平衡状态的是____ (填标号)。
A.容器内的气体压强保持不变
B.2 正(NO2)=
正(NO2)=  逆(O2)
逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为p0kPa,在800 ℃温度下该反应的平衡常数Kp=_____ kPa(用平衡分压代替平衡浓度计算,平衡时分压=平衡时总压 ×平衡时物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2 mol,平衡将_____ (填“向正反应方向移动 ”或“向逆反应方向移动”或“不移动”)。
(3)为了减少雾霾中的SO2,工业尾气中SO2可用饱和Na2SO3溶液吸收,该反应的化学方程式为_____ 。 25 ℃时,若用1 mol·L-1Na2SO3溶液吸收SO2,当恰好完全反应时,溶液中各离子浓度由大到小的顺序为_________ (已知:常温下H2SO3的电离常数K1=1.3 ×10-2,K2=6.2×10-8)。
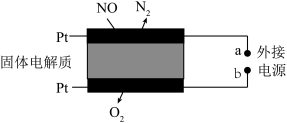
(4)电化学催化净化NO是一种新颍的处理氮氧化物的方法。原理如下图,固体电解质起到传导O2-的作用,则通入NO的电极反应式为__________ 。
(1)有下列反应:①N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol-1
②C(s)+O2(g)= CO2(g) ΔH = -393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH = - 221.0 kJ·mol-1
已知某反应的平衡常数K=
(2)往1L恒容密闭容器中充入一定最的NO2,在三种不同条件下发生反应:2NO2(g)
 | 0 | 10 | 20 | 30 | 40 | 50 |
| 实验1/800 | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 . | 0.50. |
| 实骑2/800 | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
| 实验3/850 | 1.00 | 0.50 | 0.40 | 0.35 | 0.35 | 0.35 |
A.平衡时,实验2容器内气体压强比实验1的小
B.由实验2和实验3可判断该反应是放热反应
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
E.在0~10 min内,实验2的反应速率
②不能判断该反应已达到化学平衡状态的是
A.容器内的气体压强保持不变
B.2
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为p0kPa,在800 ℃温度下该反应的平衡常数Kp=
(3)为了减少雾霾中的SO2,工业尾气中SO2可用饱和Na2SO3溶液吸收,该反应的化学方程式为
(4)电化学催化净化NO是一种新颍的处理氮氧化物的方法。原理如下图,固体电解质起到传导O2-的作用,则通入NO的电极反应式为

近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H = - 574 kJ/mol
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H = - 1160 kJ/mol
③H2O(g) = H2O(l) △H = - 44.0 kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式:_____________________________________________________________ 。
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是________________ (填代号)。

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) ΔH=a kJ/mol
N2(g)+CO2(g) ΔH=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(NO)=_____________________ ;计算该反应的平衡常数K=____________________ 。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_________ (填字母代号)。
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率____________ (填“升高”或“降低”),a________ 0(填“>”或“<”)。
(4)温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
测得有关数据如下表:
下列说法正确的是__________________ 。
A.T1>T2,且b>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H = - 574 kJ/mol
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H = - 1160 kJ/mol
③H2O(g) = H2O(l) △H = - 44.0 kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式:
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。4CO(g)+2NO2(g)
 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g) ΔH=a kJ/mol
N2(g)+CO2(g) ΔH=a kJ/mol 在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率
(4)温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。测得有关数据如下表:
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
A.T1>T2,且b>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)。


