填空题 适中0.65 引用1 组卷79
浓度均为0.01mol•L-1的盐酸(A)、醋酸溶液(B)、氢氧化钠溶液(C):
(1)写出B溶液中醋酸的电离方程式:______________ 。上述溶液稀释10倍后pH减小的是______________ (填字母)。
(2)取等体积的A、B两溶液分别加入过量的锌粉,反应开始时放出H2的速率依次为a1、a2,则a1______________ (填“>”“<”或“=”,下同)a2。反应结束时放出H2的物质的量为n1、n2,则n1______________ n2。
(3)完全中和体积与物质的量浓度均相同的两份C溶液时,需A、B两溶液的体积依次为V1、V2则V1______________ V2;若完全中和体积与pH均相同的A、B两溶液时消耗C溶液的体积分别为V(A)、V(B),则V(A)______________ V(B)。
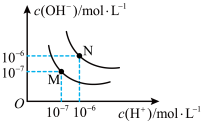
(4)图中M点表示25℃时水在电离平衡时的离子浓度N点表示T℃时水在电离平衡时的离子浓度。T℃时,3×10-3mol•L-1的氢氧化钠溶液与1×10-3mol•L-1盐酸等体积混合后溶液的pH=______________ 。
(1)写出B溶液中醋酸的电离方程式:
(2)取等体积的A、B两溶液分别加入过量的锌粉,反应开始时放出H2的速率依次为a1、a2,则a1
(3)完全中和体积与物质的量浓度均相同的两份C溶液时,需A、B两溶液的体积依次为V1、V2则V1
(4)图中M点表示25℃时水在电离平衡时的离子浓度N点表示T℃时水在电离平衡时的离子浓度。T℃时,3×10-3mol•L-1的氢氧化钠溶液与1×10-3mol•L-1盐酸等体积混合后溶液的pH=

19-20高二下·河北保定·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网