解答题-实验探究题 较难0.4 引用1 组卷214
某科研小组采用如下方案拆解废钴酸锂电池并从拆解的正极片中回收锂和钴,主要的实验流程如下:
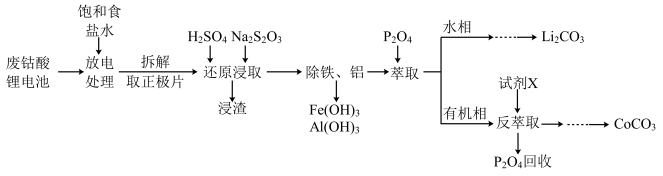
已知:①正极片中主要含LiCoO2(难溶于水)以及少量乙炔炭黑及铝箔等;负极为石墨,充电时Li+嵌入石墨电极。
②P2O4为磷酸二异辛酯,密度为0.973g.cm-3。
③3HBrO+CO(NH2)2=3HBr+N2↑+2H2O+CO2↑。
(1)“放电处理”时,有关说法正确的是__________ (填标号)。
A.有利于锂的回收,提高锂的回收率
B.处理的主要目的是回收残余的电能
C.处理过程中产生的气体只有O2
D.可防止在电池拆解过程中,发生短路引起火灾、爆炸事故等安全问题
(2)“还原浸取”时,发生反应的离子方程式为_____________ (S2O32-被氧化为SO42-)。
(3)“除铁、铝”时,应调整溶液的pH范围为___________ (下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
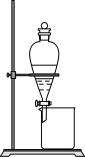
(4)“萃取”与“反萃取”时,静置后(如图所示),获得有机相的操作方法是__________ ;“反萃取”试剂X适宜是___________ (填“H2SO4”或“NaOH”)溶液。
(5)设计以流程中产品Li2CO3为原料,制取LiBr·H2O的实验方案:向烧杯中加入适量冷水,______________ ,干燥得LiBr·H2O[实验中必须使用的试剂:饱和溴水、尿素及活性炭]。

已知:①正极片中主要含LiCoO2(难溶于水)以及少量乙炔炭黑及铝箔等;负极为石墨,充电时Li+嵌入石墨电极。
②P2O4为磷酸二异辛酯,密度为0.973g.cm-3。
③3HBrO+CO(NH2)2=3HBr+N2↑+2H2O+CO2↑。
(1)“放电处理”时,有关说法正确的是
A.有利于锂的回收,提高锂的回收率
B.处理的主要目的是回收残余的电能
C.处理过程中产生的气体只有O2
D.可防止在电池拆解过程中,发生短路引起火灾、爆炸事故等安全问题
(2)“还原浸取”时,发生反应的离子方程式为
(3)“除铁、铝”时,应调整溶液的pH范围为
金属离子 | 开始沉淀的pH | 完全沉淀的pH | 开始溶解的pH |
Fe3+ | 1.1 | 3.2 | / |
Al3+ | 3.0 | 5.0 | 7.8 |

(5)设计以流程中产品Li2CO3为原料,制取LiBr·H2O的实验方案:向烧杯中加入适量冷水,
2020·江苏盐城·三模
类题推荐
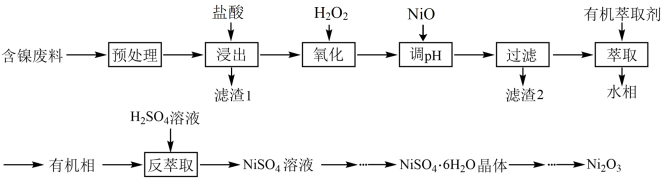
三氧化二镍(Ni2O3)经常用于制造镍氢电池,也可用于镍粉的制造,工业上利用含镍废料(主要成分为镍、铝、铁及其氧化物、碳等)回收其中的镍并制备Ni2O3的工艺流程如下所示:

已知:①NiCl2易溶于水,在该实验条件下H2O2、Fe3+不能氧化Ni2+
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
③反萃取的反应原理为NiR2+2H+ Ni2++2HR
Ni2++2HR
(1)“预处理”操作目的是除去镍废料表面的矿物油污,可选用试剂为___________ (填标号)。
A. 酒精 B.纯碱溶液 C.NaOH溶液
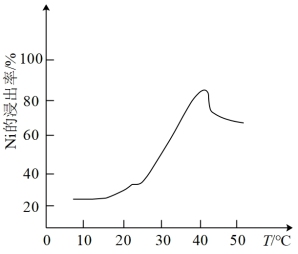
(2)酸浸时镍的浸出率与温度的关系如图所示,温度高于40℃时镍的浸出率开始下降,主要原因可能是___________ (从两个角度分析)。
(3)“氧化”时主要反应的离子方程式是___________ 。
(4)利用上述表格数据,可计算出Fe(OH)3的Ksp=___________ (用科学记数法表示,已知lg2=0.3),若“氧化”后的溶液中Ni2+浓度为0.1 mol/L,则“调pH”应控制的pH范围是___________ 。
(5)向有机相中加入 溶液能进行反萃取的原因为
溶液能进行反萃取的原因为___________ (用化学平衡移动原理解释)。
(6)资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
从NiSO4溶液获得稳定的NiSO4·6H2O晶体的操作依次是___________ 。
(7)有机相提取的Ni2+再生时可用于制备镍氢电池(碱性),该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为___________ 。

已知:①NiCl2易溶于水,在该实验条件下H2O2、Fe3+不能氧化Ni2+
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.010mol/L)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 完全沉淀时(c=1.0×10-5mol/L)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“预处理”操作目的是除去镍废料表面的矿物油污,可选用试剂为
A. 酒精 B.纯碱溶液 C.NaOH溶液
(2)酸浸时镍的浸出率与温度的关系如图所示,温度高于40℃时镍的浸出率开始下降,主要原因可能是

(3)“氧化”时主要反应的离子方程式是
(4)利用上述表格数据,可计算出Fe(OH)3的Ksp=
(5)向有机相中加入
(6)资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
| 温度 | 低于30.8℃ | 30.8℃-53.8℃ | 53.8℃-280℃ | 高于280℃ |
| 晶体形态 | NiSO4·7H2O | NiSO4·6H2O | 多种结晶水合物 | NiSO4 |
(7)有机相提取的Ni2+再生时可用于制备镍氢电池(碱性),该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为
三氧化二镍(Ni2O3)可用于制造镍氢电池,工业上利用含镍废料(主要成分为镍、铝、铁及其氧化物、碳等)回收其中的镍并制备Ni2O3的工艺流程如下:
已知:①NiCl2易溶于水,在该实验条件下H2O2、Fe3+不能氧化Ni2+
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
(1)“预处理”操作目的是除去镍废料表面的油脂,可选用试剂为___________ (填字母代号)。
A.水 B.饱和食盐水 C.NaOH溶液
(2)“酸浸”时温度过高,镍的浸出率下降,主要原因可能是___________ (答一点即可)。
(3)“氧化”时主要反应的离子方程式是___________ 。
(4)若“氧化”后的溶液中Ni2+浓度为0.01mol/L,则“调pH”应控制的pH范围是___________ 。
(5)反萃取的反应原理为 ,向有机相中加入H2SO4溶液能进行反萃取的原因为
,向有机相中加入H2SO4溶液能进行反萃取的原因为___________ (用化学平衡移动原理解释)。
(6)有机相提取的Ni2+再生时可用于制备镍氢电池(碱性),该电池充电时的总反应为 ,则放电时负极的电极反应式为
,则放电时负极的电极反应式为___________ 。
(7)确定Ni2O3固体是晶体的最可靠的科学方法是___________(填字母代号)。

已知:①NiCl2易溶于水,在该实验条件下H2O2、Fe3+不能氧化Ni2+
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.010mol/L)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 完全沉淀时( | 8.7 | 4.7 | 3.2 | 9.0 |
A.水 B.饱和食盐水 C.NaOH溶液
(2)“酸浸”时温度过高,镍的浸出率下降,主要原因可能是
(3)“氧化”时主要反应的离子方程式是
(4)若“氧化”后的溶液中Ni2+浓度为0.01mol/L,则“调pH”应控制的pH范围是
(5)反萃取的反应原理为
(6)有机相提取的Ni2+再生时可用于制备镍氢电池(碱性),该电池充电时的总反应为
(7)确定Ni2O3固体是晶体的最可靠的科学方法是___________(填字母代号)。
| A.测定熔、沸点 | B.观察外形 |
| C.对固体进行X射线衍射测定 | D.对比硬度 |
三氧化二镍(Ni2O3)是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含金属Ni、A1、Fe及其氧化物、SiO2、C等)回收其中的镍并制备Ni2O3的工艺流程如下所示:

已知:①在该实验条件下NaClO3、Fe3+不能氧化Ni2+。
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
③反萃取的反应原理为NiR2+2H+ Ni2++2HR
Ni2++2HR
(1)“预处理”的操作可以选择用_______ (填标号)来除去镍废料表面的矿物油污。
A.纯碱溶液浸泡 B.NaOH溶液浸泡 C.酒精清洗
(2)“氧化”时主要反应的离子方程式是_______ ,实际生产中为了减少杂质离子的引入,可以用来替代NaClO3的试剂是_______ (填化学式)。
(3)利用上述表格数据,计算Al(OH)3的Ksp=_______ (列出计算式),若“氧化”后的溶液中Ni2+浓度为0.1mol·L-1,则“调pH”应控制的pH范围是_______ 。
(4)向有机相中加入H2SO4溶液能进行反萃取的原因为_______ (结合平衡移动原理解释)。
(5)资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
从NiSO4溶液获得稳定的NiSO4·6H2O晶体的操作依次是_______ 。
(6)有机相提取的Ni2+再生时可用于制备镍氢电池,该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为_______ 。

已知:①在该实验条件下NaClO3、Fe3+不能氧化Ni2+。
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | A13+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.010 mol·L-1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 完全沉淀时(c=1.0×10-5 mol·L-1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“预处理”的操作可以选择用
A.纯碱溶液浸泡 B.NaOH溶液浸泡 C.酒精清洗
(2)“氧化”时主要反应的离子方程式是
(3)利用上述表格数据,计算Al(OH)3的Ksp=
(4)向有机相中加入H2SO4溶液能进行反萃取的原因为
(5)资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 | NiSO4·7H2O | NiSO4·6H2O | 多种结晶水合物 | NiSO4 |
(6)有机相提取的Ni2+再生时可用于制备镍氢电池,该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


