解答题-原理综合题 较难0.4 引用1 组卷155
以天然气为原料合成氨是现代合成氨工业发展的方向与趋势
(一)天然气与氮气为原料,以固态质子交换膜为电解质,在低温常压下通过电解原理制备氨气如图所示:
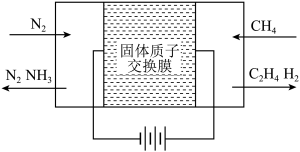
写出在阴极表面发生的电极反应式:_____________ 。
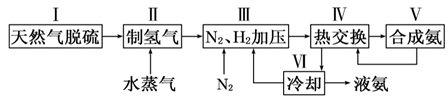
(二)天然气为原料合成氨技术简易流程如下:
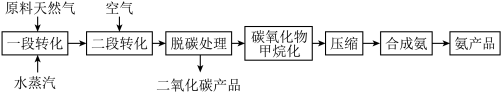
一段转化主要发生的反应如下:
①CH4(g) +H2O(g) CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
②CO(g) + H2O(g) CO2(g) + H2(g) ΔH2 = -41 kJ·molˉ1
CO2(g) + H2(g) ΔH2 = -41 kJ·molˉ1
二段转化主要发生的反应如下:
③2CH4(g)+ O2(g) 2CO(g)+4H2(g) ΔH3 = -71.2 kJ·molˉ1
2CO(g)+4H2(g) ΔH3 = -71.2 kJ·molˉ1
④2CO(g) + O2(g) 2CO2(g) ΔH4 = -282 kJ·molˉ1
2CO2(g) ΔH4 = -282 kJ·molˉ1
(1)已知CO中不含C=O,H-H的键能为436 kJ·molˉ1,H-O的键能为463 kJ·molˉ1,C-H的键能为414 kJ·molˉ1,试计算C=O的键能_________ 。
(2)实验室模拟一段转化过程,在800oC下,向体积为1L的恒容密闭反应器中,充入1mol的CH4与1mol的H2O,达到平衡时CH4的转化率为40%,n(H2)为1.4mol,请计算反应②的平衡常数_________ 。
(3)下列说法正确的是_________ 。
A.合成氨过程实际选择的温度约为700℃,温度过高或过低都会降低氨气平衡产率
B.上述工业流程中压缩既能提高反应速率又能提高合成氨的产率
C.二段转化释放的热量可为一段转化提供热源,实现能量充分利用
D.二段转化过程中,需严格控制空气的进气量,否则会破坏合成气中的氢氮比
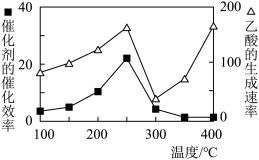
(4)已知催化合成氨中催化剂的活性与催化剂的负载量、催化剂的比表面积和催化反应温度等因素有关,如图所示:
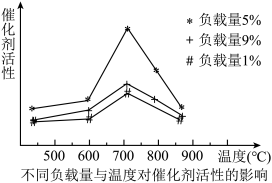
①实验表明相同温度下,负载量5%催化剂活性最好,分析负载量9%与负载量1%时,催化剂活性均下降的可能原因是________ 。
②在上图中用虚线作出负载量为3%的催化剂活性变化曲线_______ 。
(一)天然气与氮气为原料,以固态质子交换膜为电解质,在低温常压下通过电解原理制备氨气如图所示:

写出在阴极表面发生的电极反应式:
(二)天然气为原料合成氨技术简易流程如下:

一段转化主要发生的反应如下:
①CH4(g) +H2O(g)
②CO(g) + H2O(g)
二段转化主要发生的反应如下:
③2CH4(g)+ O2(g)
④2CO(g) + O2(g)
(1)已知CO中不含C=O,H-H的键能为436 kJ·molˉ1,H-O的键能为463 kJ·molˉ1,C-H的键能为414 kJ·molˉ1,试计算C=O的键能
(2)实验室模拟一段转化过程,在800oC下,向体积为1L的恒容密闭反应器中,充入1mol的CH4与1mol的H2O,达到平衡时CH4的转化率为40%,n(H2)为1.4mol,请计算反应②的平衡常数
(3)下列说法正确的是
A.合成氨过程实际选择的温度约为700℃,温度过高或过低都会降低氨气平衡产率
B.上述工业流程中压缩既能提高反应速率又能提高合成氨的产率
C.二段转化释放的热量可为一段转化提供热源,实现能量充分利用
D.二段转化过程中,需严格控制空气的进气量,否则会破坏合成气中的氢氮比
(4)已知催化合成氨中催化剂的活性与催化剂的负载量、催化剂的比表面积和催化反应温度等因素有关,如图所示:

①实验表明相同温度下,负载量5%催化剂活性最好,分析负载量9%与负载量1%时,催化剂活性均下降的可能原因是
②在上图中用虚线作出负载量为3%的催化剂活性变化曲线
17-18高二下·浙江丽水·期末
类题推荐
甲醇CH3OH)是一种重要的化工原料,工业上有多种方法可制得甲醇成品
(一)以CO、H2和CO2制备甲醇
①CO2(g)+H2(g) COg)+H2O(g) ∆H1
COg)+H2O(g) ∆H1
②CO(g)+2H2 (g) CH3OH(g) △H2
CH3OH(g) △H2
③CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H3
CH3OH(g)+H2O(g) ∆H3
(1)已知:反应①的化学平衡常数K和温度的关系如下表
则下列说法正确的是______
A.反应①正反应是吸热反应
B.一定体积的密闭容器中,压强不再变化时,说明反应①达到平衡状态
C.1100℃时,反应①的K可能为1.5
D.在1000℃时,[c(CO2)·c(H2)]/[c(CO)·c(H2O)]约为0.59
(2)比较△H2_____ △H3(填“>”、“=”或“<”)
(3)现利用②和③两个反应合成CH3OH,已知CO可使反应的催化剂寿命下降若氢碳比表示为f=[n(H2)-n(CO2)]/[n(CO)+n(CO2)],则理论上f=_____ 时,原料气的利用率高,但生产中住往采用略高于该值的氯碳比,理由是_________________________________ .
(二)以天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2Og) CO(g)+3H2(g) ∆H1>0
CO(g)+3H2(g) ∆H1>0
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g) ∆H2>0
CH3OH(g) ∆H2>0
在一定压强下,1 mol CH4(g)和1 mol H2O(g)在三种不同催化剂作用下发生反应(i),经历相同时间时,CO的物质的量(n)随温度变化的关系如图1
(1)下列说法正确的是_______
A.曲线①中n(CO)随温度变化的原因是正反应为吸热反应,升高温度,平衡向右移动
B.三种催化剂中,催化剂③的催化效果最好,所以能获得最高的产率
C.当温度低于700℃时的曲线上的点可能都没有到达平衡
D.若温度大于700℃时,CO的物质的量保持不变
(2)500℃时,反应(1)在催化剂①的作用下到10min时达到平衡,请在图2中画出反应(1)在此状态下0至12分钟内反应体系中H2的体积分数 (H2)随时间t变化的总趋势
(H2)随时间t变化的总趋势___________________

(三)研究表明,CO也可在酸性条件下通过电化学的方法制备甲醇,原理如图3所示。
(1)产生甲醇的电极反应式为___________________ ;
(2)甲醇燃料电池应用很广,其工作原理如图4,写出电池工作时的负极反应式:___________ 。

(一)以CO、H2和CO2制备甲醇
①CO2(g)+H2(g)
②CO(g)+2H2 (g)
③CO2(g)+3H2(g)
(1)已知:反应①的化学平衡常数K和温度的关系如下表
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
则下列说法正确的是
A.反应①正反应是吸热反应
B.一定体积的密闭容器中,压强不再变化时,说明反应①达到平衡状态
C.1100℃时,反应①的K可能为1.5
D.在1000℃时,[c(CO2)·c(H2)]/[c(CO)·c(H2O)]约为0.59
(2)比较△H2
(3)现利用②和③两个反应合成CH3OH,已知CO可使反应的催化剂寿命下降若氢碳比表示为f=[n(H2)-n(CO2)]/[n(CO)+n(CO2)],则理论上f=
(二)以天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2Og)
(ii)合成甲醇:CO(g)+2H2(g)
在一定压强下,1 mol CH4(g)和1 mol H2O(g)在三种不同催化剂作用下发生反应(i),经历相同时间时,CO的物质的量(n)随温度变化的关系如图1
(1)下列说法正确的是
A.曲线①中n(CO)随温度变化的原因是正反应为吸热反应,升高温度,平衡向右移动
B.三种催化剂中,催化剂③的催化效果最好,所以能获得最高的产率
C.当温度低于700℃时的曲线上的点可能都没有到达平衡
D.若温度大于700℃时,CO的物质的量保持不变
(2)500℃时,反应(1)在催化剂①的作用下到10min时达到平衡,请在图2中画出反应(1)在此状态下0至12分钟内反应体系中H2的体积分数

(三)研究表明,CO也可在酸性条件下通过电化学的方法制备甲醇,原理如图3所示。
(1)产生甲醇的电极反应式为
(2)甲醇燃料电池应用很广,其工作原理如图4,写出电池工作时的负极反应式:

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2NH3(g)(正反应为放热反应),当反应达到平衡时,N2和H2的浓度比是
2NH3(g)(正反应为放热反应),当反应达到平衡时,N2和H2的浓度比是

