解答题-实验探究题 适中0.65 引用1 组卷179
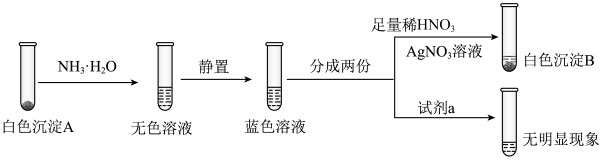
某学习小组探究SO2与Cu(OH)2悬浊液的反应。
实验Ⅰ:向NaOH溶液中加入浓CuCl2溶液,制得含Cu(OH)2的悬浊液,测溶液pH≈13。向悬浊液中通入SO2,产生大量白色沉淀,测溶液pH≈3。推测白色沉淀中可能含有Cu+、Cu2+、Cl-、SO42-、SO32-、HSO3-。
已知: i. Cu(NH3)42+(蓝色);Cu+ Cu(NH3)2+(无色);Cu+
Cu(NH3)2+(无色);Cu+ Cu+Cu2+
Cu+Cu2+
ii. Ag2SO4微溶于水,可溶于一定浓度的硝酸。
实验Ⅱ:

(1)①通过“白色沉淀A”确定一定存在的离子是____________________ 。
②判断白色沉淀中金属离子仅含有Cu+、不含Cu2+的实验证据是____________________ 。
③用以证实白色沉淀中无SO42-、SO32-、HSO3-的试剂a是____________________ 。
④生成CuCl的离子方程式是____________________ 。
(2)小组同学基于上述实验认为: SO2与Cu(OH)2悬浊液能发生氧化还原反应不仅基于本身的性质,还受到“生成了沉淀促进了氧化还原反应的发生”的影响。设计实验验证了此观点。
①用实验Ⅰ方法制得含Cu(OH)2的悬浊液,过滤、洗涤获取纯净的Cu(OH)2固体。检验Cu(OH)2固体是否洗涤干净的方法是____________________ 。
②经确认浅黄色沉淀是CuOH,红色固体是Cu,证明SO2与Cu(OH)2悬浊液发生了氧化还原反应。最终生成Cu的原因是____________________ 。
③由实验III、IV可以得出的结论除“生成了沉淀促进了氧化还原反应的发生” 外还有____________________ 。
实验Ⅰ:向NaOH溶液中加入浓CuCl2溶液,制得含Cu(OH)2的悬浊液,测溶液pH≈13。向悬浊液中通入SO2,产生大量白色沉淀,测溶液pH≈3。推测白色沉淀中可能含有Cu+、Cu2+、Cl-、SO42-、SO32-、HSO3-。
已知: i. Cu(NH3)42+(蓝色);Cu+
ii. Ag2SO4微溶于水,可溶于一定浓度的硝酸。
实验Ⅱ:

(1)①通过“白色沉淀A”确定一定存在的离子是
②判断白色沉淀中金属离子仅含有Cu+、不含Cu2+的实验证据是
③用以证实白色沉淀中无SO42-、SO32-、HSO3-的试剂a是
④生成CuCl的离子方程式是
(2)小组同学基于上述实验认为: SO2与Cu(OH)2悬浊液能发生氧化还原反应不仅基于本身的性质,还受到“生成了沉淀促进了氧化还原反应的发生”的影响。设计实验验证了此观点。
①用实验Ⅰ方法制得含Cu(OH)2的悬浊液,过滤、洗涤获取纯净的Cu(OH)2固体。检验Cu(OH)2固体是否洗涤干净的方法是
| 编号 | 实验 | 现象 |
| III | 向Cu(OH)2固体中加入一定量的水,制得悬浊液(pH≈8),向悬浊液中通入SO2 | a. 底部产生少量浅黄色沉淀,慢慢消失 b. 静置,底部产生少量红色固体 |
| IV | 向CuSO4溶液中通入SO2 | 无沉淀产生 |
②经确认浅黄色沉淀是CuOH,红色固体是Cu,证明SO2与Cu(OH)2悬浊液发生了氧化还原反应。最终生成Cu的原因是
③由实验III、IV可以得出的结论除“生成了沉淀促进了氧化还原反应的发生” 外还有
19-20高三下·北京海淀·阶段练习
类题推荐
某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。向硝酸酸化的0.05mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:取出少量黑色固体,洗涤后,___ (填操作和现象),证明黑色固体中含有Ag。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___ (用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于___ (用离子方程式表示),可氧化产生Fe3+;
假设c:酸性溶液中存在的___ 离子具有氧化性,可氧化产生Fe3+;
假设d:根据加入KSCN溶液后产生白色沉淀的现象,判断溶液中一定存在Ag+,Ag+可氧化Fe2+产生Fe3+。
③下述实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的___ 溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min时溶液呈浅红色,30min后溶液几乎无色。
实验Ⅱ:设计实验证明假设d成立___ 。
(3)根据ⅰ~ⅲ实验现象,结合本题涉及的三个方程式,推测实验ⅰ~ⅲ中Fe3+浓度变化的原因(用离子方程式和文字结合表述):___ 。
(1)检验产物:取出少量黑色固体,洗涤后,
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是
| 序号 | 取样时间/min | 现象 |
| i | 3 | 产生大量白色沉淀;溶液呈红色 |
| ii | 30 | 产生白色沉淀,较3min时量少;溶液红色较3min时加深 |
| iii | 120 | 产生白色沉淀,较30min时量少;溶液红色较30min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于
假设c:酸性溶液中存在的
假设d:根据加入KSCN溶液后产生白色沉淀的现象,判断溶液中一定存在Ag+,Ag+可氧化Fe2+产生Fe3+。
③下述实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的
实验Ⅱ:设计实验证明假设d成立
(3)根据ⅰ~ⅲ实验现象,结合本题涉及的三个方程式,推测实验ⅰ~ⅲ中Fe3+浓度变化的原因(用离子方程式和文字结合表述):
某小组在验证反应“Fe + 2Ag+=Fe2+ + 2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:
①取少量黑色固体,洗涤后,____________________________________ (填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加__________ 溶液,产生蓝色沉淀,说明溶液中含有_____________ 。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是________________________ (用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,白色沉淀:___________ (化学式),且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________________________ (用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+_________________ (用离子方程式表示)
假设d:根据加入KSCN溶液后产生白色现象,判断溶液中存在Ag+,可产生Fe3+。请写出产生Fe3+的离子方程式:______________________________ 。
③ 下列实验可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验:向硝酸酸化的__________ 溶液溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______________________________________________________________________________ 。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:
①取少量黑色固体,洗涤后,
②取上层清液,滴加
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,白色沉淀:
| 序号 | 取样时间/min | 现象 |
| i | 3 | 产生大量白色沉淀;溶液呈红色 |
| ii | 30 | 产生白色沉淀较3min时量少;溶液红色较3min时加深 |
| iii | 120 | 产生白色沉淀较30min时量少;溶液红色较30min时变浅 |
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+
假设d:根据加入KSCN溶液后产生白色现象,判断溶液中存在Ag+,可产生Fe3+。请写出产生Fe3+的离子方程式:
③ 下列实验可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验:向硝酸酸化的
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网