解答题-原理综合题 适中0.65 引用1 组卷136
弱电解质在水溶液中的电离状况可以进行定量计算和推测。
(1)25℃时两种酸的电离平衡常数如表所示。
①25℃时,0.100mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是:___ 。pH=8的NaA溶液中由水电离出的c(OH-)=___ mol·L-1。
②25℃时,0.100mol·L-1的NaHB溶液pH___ 7,理由是___ 。
③25℃时,向0.100mol·L-1的Na2B溶液中滴加足量0.100mol·L-1的HA溶液,反应的离子方程式为___ 。
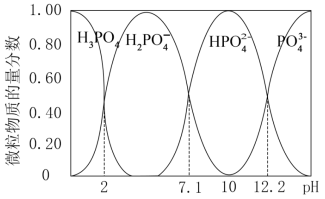
(2)已知25℃时,向0.100mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。
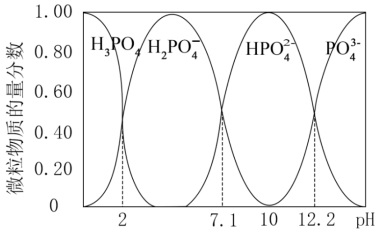
①当溶液pH由11到14时,所发生反应的离子方程式为:___ 。
(1)25℃时两种酸的电离平衡常数如表所示。
| Ka1 | Ka2 | |
| HA | 1×10-4 | |
| H2B | 1×10-2 | 5×10-6 |
①25℃时,0.100mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是:
②25℃时,0.100mol·L-1的NaHB溶液pH
③25℃时,向0.100mol·L-1的Na2B溶液中滴加足量0.100mol·L-1的HA溶液,反应的离子方程式为
(2)已知25℃时,向0.100mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。

①当溶液pH由11到14时,所发生反应的离子方程式为:
19-20高二下·江苏宿迁·阶段练习
类题推荐
下表是几种常见弱酸的电离平衡常数:
(1)写出碳酸的电离方程式_______
(2)25℃时,向NaClO溶液中通入少量CO2,反应的离子方程式_______
(3)①常温下,用0.100mol/LNaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,c点所示溶液中:2c(C2O )+2c(HC2O
)+2c(HC2O )+2c(H2C2O4)=c(Na+),该草酸溶液的物质的量浓度为
)+2c(H2C2O4)=c(Na+),该草酸溶液的物质的量浓度为_______ mol·L-1
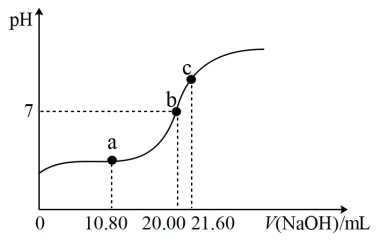
②a点所示溶液中,c(Na+)、c(H+)、c(OH-)、c(HC2O )、c(C2O
)、c(C2O )各离子的浓度由大到小的顺序为
)各离子的浓度由大到小的顺序为_______
(4)滴定过程中选择的指示剂为_______ ,滴定终点的颜色变化为_______ 。
(5)常温下,将SO2通入氨水中,当溶液中的 =
= 时,此时使溶液的pH为
时,此时使溶液的pH为_______ 。
| 化学式 | HClO | H2SO3 | HCN | H2CO3 | H2C2O4 |
| 电离平衡常数 | K=4.0×10-8 | K1=1.2×10-2 K2=6.6×10-8 | K=6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.4×10-5 |
(1)写出碳酸的电离方程式
(2)25℃时,向NaClO溶液中通入少量CO2,反应的离子方程式
(3)①常温下,用0.100mol/LNaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,c点所示溶液中:2c(C2O

②a点所示溶液中,c(Na+)、c(H+)、c(OH-)、c(HC2O
(4)滴定过程中选择的指示剂为
(5)常温下,将SO2通入氨水中,当溶液中的
已知如表数据。
(1)25℃时,pH=11的NaCN溶液中水电离出的c(OH-)=_____ mol•L-1。
(2)25℃时,等浓度的NaCN、Na2CO3溶液、CH3COONa三种溶液的pH值由大到小的顺序为_____ 。
(3)0.100mol•L-1NH4HCO3溶液中物质的量浓度最大的离子是_____ (填化学式)。
(4)向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_____ 。
(5)25℃1.10mol•L-1CH3COOH溶液中,CH3COOH的电离度约为_____ 。
(6)25℃时等体积等浓度的NaCl与NaCN两溶液中,离子总数NaCl_____ NaCN(填“大于”、“小于”或“等于”);
(7)HCN与NaOH反应后的溶液中存在:c(Na+)=c(CN-),该溶液呈_____ 性(填“酸”“碱”或“中”)。
| 化学式 | 电离平衡常数(25℃) |
| HCN | Ka=4.93×10-10 |
| CH3COOH | Ka=1.76×10-5 |
| H2CO3 | Ka1=4.30×10-7 |
| NH3·H2O | Kb=1.77×10-5 |
(2)25℃时,等浓度的NaCN、Na2CO3溶液、CH3COONa三种溶液的pH值由大到小的顺序为
(3)0.100mol•L-1NH4HCO3溶液中物质的量浓度最大的离子是
(4)向NaCN溶液中通入少量CO2,所发生反应的化学方程式为
(5)25℃1.10mol•L-1CH3COOH溶液中,CH3COOH的电离度约为
(6)25℃时等体积等浓度的NaCl与NaCN两溶液中,离子总数NaCl
(7)HCN与NaOH反应后的溶液中存在:c(Na+)=c(CN-),该溶液呈
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网