解答题-原理综合题 0.65 引用1 组卷217
硫元素在自然界中通常以硫化物、硫酸盐或单质的形式存在,其单质和化合物在工农业生产中有着重要的作用。
(1)硫元素在周期表中的位置为___________ ,其最简单气态氢化物的电子式为_________ 。
(2)在工业上SO2可以用于制备H2SO4。
已知SO2(g)+ O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
H2O(g)=H2O(l) △H2=-44kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H3=-130kJ·mol-1
则2SO2(g)+O2(g)=2SO3(g) △H=_____________ kJ·mol-1
(3)某兴趣小组同学探究SO2的还原性,使用的药品和装置如图所示:
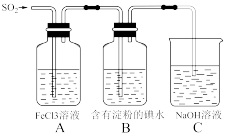
A瓶中发生反应的离子方程式为_______________________ 。B瓶中出现的现象为________ 。若要证明A、B的反应中SO2均显现还原性被氧化为SO42—,可以采取的操作和现象是_______________________________________ 。
(4)硫的氧化物排放到大气中会造成空气污染,常温常压下用如图所示传感器可以检测空气中SO2的含量。下列关于该传感器的叙述正确的是__________ (填序号)。
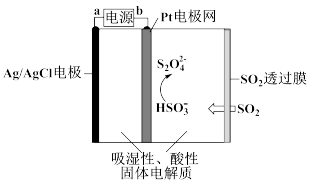
A. a为电源的正极
B. Pt电极网上发生氧化反应
C.当电路中电子转移0.5mol时,进入传感器的SO2为11.2L
D.阴极的电极反应是2HSO3—+2H+-2e—=S2O42—+2H2O
(1)硫元素在周期表中的位置为
(2)在工业上SO2可以用于制备H2SO4。
已知SO2(g)+
H2O(g)=H2O(l) △H2=-44kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H3=-130kJ·mol-1
则2SO2(g)+O2(g)=2SO3(g) △H=
(3)某兴趣小组同学探究SO2的还原性,使用的药品和装置如图所示:

A瓶中发生反应的离子方程式为
(4)硫的氧化物排放到大气中会造成空气污染,常温常压下用如图所示传感器可以检测空气中SO2的含量。下列关于该传感器的叙述正确的是

A. a为电源的正极
B. Pt电极网上发生氧化反应
C.当电路中电子转移0.5mol时,进入传感器的SO2为11.2L
D.阴极的电极反应是2HSO3—+2H+-2e—=S2O42—+2H2O
19-20高三上·贵州贵阳·阶段练习


